Človek si je vedno prizadeval najti materiale, ki svojim konkurentom ne puščajo možnosti. Znanstveniki že od antičnih časov iščejo najtrše materiale na svetu, najlažje in najtežje. Žeja po odkritju je pripeljala do odkritja idealnega plina in idealnega črnega telesa. Predstavljamo vam najbolj neverjetne snovi na svetu.
1. Črna snov
Najtemnejša snov na svetu se imenuje Vantablack in je sestavljena iz zbirke ogljikovih nanocevk (glej ogljik in njegove alotropne spremembe). Preprosto povedano, material je sestavljen iz neskončnega števila "dlačic", pri katerih se svetloba odbije od ene cevi do druge. Tako se absorbira približno 99,965% svetlobnega toka in le majhen del se odbije nazaj navzven.
Odkritje Vantablacka odpira široke možnosti za uporabo tega materiala v astronomiji, elektroniki in optiki.
2. Najbolj vnetljiva snov
Klor trifluorid je najbolj vnetljiva snov, kar jih je človeštvo kdaj poznalo. Je najmočnejše oksidant in reagira s skoraj vsemi kemičnimi elementi. Klor trifluorid lahko pregori beton in zlahka vžge steklo! Uporaba klorovega trifluorida je zaradi njegove izjemne vnetljivosti in nezmožnosti zagotavljanja varnosti uporabe praktično nemogoča.
3. Najbolj strupena snov
Najmočnejši strup je botulinski toksin. Poznamo ga pod imenom Botox, tako se imenuje v kozmetologiji, kjer je našel svojo glavno uporabo. Botulinum toksin je kemikalija, ki jo izloča bakterija Clostridium botulinum. Poleg tega, da je botulinski toksin najbolj strupena snov, ima tudi največjo molekulsko maso med beljakovinami. Fenomenalna strupenost snovi dokazuje dejstvo, da je le 0,00002 mg min / l botulinskega toksina dovolj, da je prizadeto območje za pol dni smrtonosno za ljudi.
4. Najbolj vroča snov
To je tako imenovana kvark-gluonska plazma. Snov je nastala pri trčenju atomov zlata pri skoraj svetlobni hitrosti. Quark-gluonska plazma ima temperaturo 4 bilijone stopinj Celzija. Za primerjavo, ta številka je 250.000 -krat višja od temperature Sonca! Na žalost je življenjska doba snovi omejena na bilijontino ene bilijontine sekunde.
5. Najbolj jedka kislina
V tej nominaciji je prvak fluorid-antimična kislina H. Fluorid-antimonska kislina je 2 × 10 16 (dvesto kvintiljonov) krat bolj jedka kot žveplova kislina. Je zelo aktivna snov, ki lahko eksplodira, če ji dodamo majhno količino vode. Hlapi te kisline so smrtonosno strupeni.
6. Najbolj eksplozivna snov
Najbolj eksplozivna snov je heptanitrokuban. Je zelo drag in se uporablja samo za znanstvene raziskave. Toda nekoliko manj eksploziven HMX se uspešno uporablja v vojaških zadevah in v geologiji pri vrtanju vrtin.
7. Najbolj radioaktivna snov
"Polonij-210" je izotop polonija, ki v naravi ne obstaja, ampak ga proizvaja človek. Uporablja se za ustvarjanje miniaturnih, a hkrati zelo močnih virov energije. Ima zelo kratko razpolovno dobo in zato lahko povzroči hudo sevalno bolezen.
8. Najtežja snov
To je seveda fullerit. Njegova trdota je skoraj 2 -krat večja kot pri naravnih diamantih. Več o fuleritu lahko preberete v našem članku Najtrši materiali na svetu.
9. Najmočnejši magnet
Najmočnejši magnet na svetu je sestavljen iz železa in dušika. Trenutno podrobnosti o tej snovi niso na voljo širši javnosti, vendar je že znano, da je novi super -magnet 18% močnejši od najmočnejših magnetov, ki so trenutno v uporabi - neodima. Neodimijski magneti so narejeni iz neodima, železa in bora.
10. Najbolj tekoča snov
Superfluidni helij II pri temperaturah blizu absolutne ničle skoraj nima viskoznosti. Ta lastnost je odgovorna za svojo edinstveno lastnost, da pronica in izlije iz posode iz katerega koli trdnega materiala. Helij II ima možnosti za uporabo kot idealen toplotni prevodnik, pri katerem se toplota ne odvaja.
Govori se, da za vsako vrsto snovi obstaja "najbolj ekstremna" možnost.
Zanima me, kaj se lahko zgodi, če robove ogljikovih nanocevk zložite drug na drugega in jih zamenjate? Rezultat je material, ki absorbira 99,9% svetlobe, ki jo zadene. Mikroskopska površina tega materiala je neenakomerna in hrapava, lomi svetlobo in je slaba odbojna površina. Nato poskusite uporabiti ogljikove nanocevke kot superprevodnike v določenem vrstnem redu, tako da postanejo odlični absorberji svetlobe, in dobili boste pravo črno nevihto. Znanstveniki so resno navdušeni nad potencialno uporabo te snovi, saj pravzaprav nobena svetloba ni "izgubljena". To snov bi lahko uporabili za izboljšanje optičnih naprav, kot so teleskopi, in celo za sončne celice, ki delujejo s skoraj 100% izkoristkom.
9. Najbolj vnetljiva snov na svetu
Mnoge snovi gorijo z osupljivo hitrostjo, na primer stirof, napalm, in to je šele začetek. Kaj pa bi se zgodilo, če bi obstajala snov, ki bi z ognjem lahko prekrila vso zemljo? Čeprav je to provokativno vprašanje, je bilo postavljeno kot izhodišče. Klor trifluorid ima zelo dvomljivo slavo kot strašno vnetljiva snov, kljub temu, da so nacisti menili, da je ta snov preveč nevarna za delo. Ko ljudje, ki razpravljajo o genocidu, menijo, da njihov namen v življenju ne uporabljajo ničesar, ker je preveč smrtonosno, to podpira previdno ravnanje s temi snovmi. Govori se, da se je enkrat tona snovi razlila in začel požar ter 12 palcev (30,48 cm; pribl. Mixednews) betona in meter peska in gramoza je izgorelo, dokler ni vse zamrlo. Na žalost so imeli nacisti prav.
8. Najbolj strupena snov od vseh obstoječih
Kakšno snov bi najraje dobili na obrazu? Lahko bi bil najsmrtonosnejši strup, ki bo upravičeno zasedel 3. mesto med glavnimi ekstremnimi snovmi. Tak strup se od najmočnejše kisline na svetu (ki bo kmalu izumljena) res razlikuje po tem, da gori skozi beton. Čeprav to ni povsem res, ste verjetno vsi brez dvoma slišali od medicinske stroke o botoksu. Tako je po njegovi zaslugi postal najbolj smrtonosni strup. Botox uporablja botulinski toksin, ki ga proizvaja bakterija Clostridium botulinum, kislina, ki je tako smrtonosna, da ekvivalent zrna soli zadostuje za ubijanje 200-kilogramske osebe. Po mnenju znanstvenikov je tako nevarno, da je dovolj, da razpršimo le 4 kg te snovi, da ubijemo vse ljudi na zemlji. Verjetno bi orel z klopotačo ravnal veliko bolj človeško kot ta strup z moškim.

7. Najbolj vroča snov
Na svetu je zelo malo stvari, za katere je znano, da so bolj vroče od notranjosti pred kratkim ogrevanega vročega žepa, vendar se zdi, da ta snov ruši tudi ta rekord. Snov, ki nastane pri trčenju atomov zlata pri skoraj svetlobni hitrosti, se imenuje kvark-gluonska "juha" in doseže norih 4 bilijone stopinj Celzija, kar je skoraj 250.000-krat vroče kot material znotraj Sonca. Količina energije, ki se sprosti pri trku, bi zadostovala za taljenje protonov in nevtronov, ki ima sam po sebi lastnosti, za katere nikoli niste vedeli, da obstajajo. Znanstveniki pravijo, da bi nam ta snov lahko predstavila, kakšno je bilo rojstvo našega vesolja, zato je vredno razumeti, da drobne supernove niso ustvarjene za zabavo. Res pa je dobra novica, da je "juha" zavzela eno bilijontino palca in zdržala trilijontino ene bilijontine sekunde.

Kislina je zelo grozna snov. V filmu so eni najstrašnejših pošasti dali kislo kri, da bi bil še bolj grozen kot le stroj za ubijanje ("Alien"). Zdaj zagotovo vemo, da je izpostavljenost kislinam zelo slaba. Če bi bili "vesoljci" napolnjeni s fluorid-antimonsko kislino, ne bi le padli globoko skozi tla, ampak bi hlapi, ki jih oddajajo iz njihovih trupel, pobili vse okoli sebe. Ta kislina je 21019 -krat močnejša od žveplove kisline in lahko celo prodre skozi steklo. Lahko tudi eksplodira, če dodamo vodo. Med to reakcijo se sproščajo strupeni hlapi, ki lahko ubijejo vsakogar v sobi. Morda bi morali že preiti na drugo snov ...

Pravzaprav tega mesta trenutno ni mogoče razdeliti na dve komponenti: HMX in heptanitrokuban. Heptanitrokuban večinoma obstaja v laboratorijih in je podoben HMX, vendar ima gostejšo kristalno strukturo, ki nosi večji potencial za uničenje. Oktogen pa obstaja v dovolj velikih količinah, da ogrozi fizični obstoj vseh živih bitij. Uporablja se v trdnem gorivu za rakete in celo za detonatorje jedrskega orožja. In zadnja je najslabša, saj kljub enostavnosti, s katero se to dogaja v filmih, začetek cepitve / termonuklearne reakcije, ki vodi v svetleče žareče jedrske oblake, podobno gobam, ni lahka naloga. Vendar pa HMX z njim odlično opravlja svoje delo.

4. Najbolj radioaktivna snov na svetu
Ko govorimo o sevanju, velja omeniti, da so žareče zelene palice "plutonija", prikazane v Simpsonovih, le fikcija. Če je nekaj radioaktivno, to ne pomeni, da bi moralo žareti. To je treba omeniti, saj je "polonij-210" tako radioaktiven, da sveti modro. Nekdanji sovjetski vohun Aleksander Litvinenko je bil zaveden, ko so mu dodali hrano, in kmalu za tem umrl zaradi raka. S to snovjo se ne smemo šaliti, sijaj povzroča zrak okoli snovi, na katerega vpliva sevanje, in pravzaprav se lahko predmeti okoli nje segrejejo. Ko rečemo "sevanje", mislimo na primer na jedrski reaktor ali eksplozijo, kjer dejansko poteka cepitvena reakcija. To je samo sproščanje ioniziranih delcev, ne pa tudi cepitev atomov izven nadzora.

3. Najtežja snov
Če menite, da so diamanti najtežja snov na Zemlji, je to dobra, a nenatančna domneva. Je tehnično oblikovana diamantna nanorodica. To je pravzaprav zbirka diamantov v nano merilu z najnižjim kompresijskim razmerjem in najtežjo snovjo, ki jo pozna človek. Ta snov je bila izumljena v Nemčiji leta 2005 in se bo verjetno uporabljala v enaki meri kot industrijski diamanti, le da je nova snov bolj odporna proti obrabi kot običajni diamanti. Te stvari so celo težje od algebre.

2. Najbolj magnetna snov
Če bi bil induktor majhen črn kos, bi bila to ista snov. Snov, razvita leta 2010 iz železa in dušika. Ima magnetne sposobnosti, ki so 18% več kot prejšnji "rekorder" in je tako močan, da je znanstvenike prisilil, da premislijo, kako deluje magnetizem. Oseba, ki je odkrila to snov, se je oddaljila od svojih študij, tako da nobeden od drugih znanstvenikov ni mogel reproducirati njegovega dela, saj so poročali, da je bila podobna spojina razvita na Japonskem v preteklosti leta 1996, vendar je drugi fiziki niso mogli reproducirati, zato ta snov ni bila uradno sprejeta. Ni jasno, ali naj bi japonski fiziki obljubili, da bodo v teh okoliščinah naredili Sepuku. Če bi to snov lahko reproducirali, bi to lahko pomenilo novo dobo učinkovite elektronike in magnetnih motorjev, ki bi se po moči morda povečala za red velikosti.

1. Najmočnejša superfluidnost
Pretočnost je stanje snovi (na primer trdno ali plinasto), ki se pojavi pri izredno nizkih temperaturah, visoki toplotni prevodnosti (vsaka unča te snovi mora imeti popolnoma enako temperaturo) in nima viskoznosti. Helij-2 je najbolj tipičen predstavnik. Skodelica helija-2 se bo spontano dvignila in izlila iz posode. "Helij-2" bo prodrl tudi skozi druge trdne materiale, saj popolna odsotnost sile trenja omogoča, da teče skozi druge nevidne luknje, skozi katere navaden helij (ali voda v tem primeru) ni mogel pobegniti. "Helij-2" ne pride v želeno stanje pri številki 1, kot da ima sposobnost samostojnega delovanja, čeprav je tudi najučinkovitejši toplotni prevodnik na Zemlji, nekaj stokrat boljši od bakra. Toplota tako hitro potuje skozi "helij-2", da potuje v valovih, kot je zvok (pravzaprav znan kot "drugi zvok"), namesto da se razprši in se preprosto premika iz ene molekule v drugo. Mimogrede, sile, ki nadzorujejo sposobnost "helija-2", da plazi po steni, imenujemo "tretji zvok". Verjetno ne boste imeli kaj bolj ekstremnega kot snov, ki je zahtevala opredelitev dveh novih vrst zvoka.

Hiter razvoj znanosti omogoča znanstvenikom nova senzacionalna odkritja na področju fizike, kemije in na drugih področjih. Znanstveni svet sistematično pretresa novica o ustvarjanju novih snovi z edinstvenimi, prej nevidnimi lastnostmi. Seveda navadni ljudje ne sledijo vedno takšnim odkritjem. Vsi ne vedo, da je leta 2005 v Ameriki nastala najmočnejša kislina na svetu. Za mnoge najmočnejša kemikalija ostaja žveplova kislina, ki so jo v šoli dobro preučili.
Ogljikova kislina je najmočnejša na svetu
Leta 2005 je znanstvenikom, ki delajo na Kalifornijski univerzi v ZDA, uspelo ustvariti novo kislino brez primere. Izumljena spojina je milijonkrat močnejša od koncentrirane žveplove kisline. Znanstveniki so se v tistem trenutku lotili iskanja nove molekule, ki bi postala pravo odkritje v znanstvenem svetu, in uspeli so doseči pozitiven rezultat.

Formula ogljikove kisline se ne razlikuje po kompleksnosti: H (CHB11Cl11). Kljub temu v običajnem laboratoriju takšne snovi ne bo mogoče sintetizirati. Ogljikova kislina je več kot trilijon krat bolj kisla kot navadna voda.
Edinstvena lastnost najmočnejše kisline
Če kjer koli omenjamo najmočnejšo kislino na svetu, človeška domišljija potegne snov, ki raztopi vse, kar ji pride na pot. Dejansko uničevalne lastnosti sploh niso glavni simptom moči kemikalije. Mnogi so na primer verjeli, da je fluorovodikova kislina najmočnejša kislina, ker raztaplja steklo. Toda to je daleč od resnice. Fluorovodikova kislina razjeda steklene posode, lahko pa jih shranimo v polietilenskih posodah.

Prepoznana kot najmočnejša na svetu, lahko ogljikovo kislino enostavno shranimo v steklene posode. Dejstvo je, da je za to kemikalijo značilna velika kemijska stabilnost. Tako kot druge podobne spojine tudi ogljikova kislina v reakciji z reagenti oddaja nabite atome vodika. Po takšni reakciji ima sestavek rahel negativni naboj in nima uničujočega učinka na okoliške materiale.
Nadaljnje delo z ogljikovo kislino
Seveda so ustvarjalci ogljikove kisline postali znani v svetovni znanstveni skupnosti. Poleg tega so briljantni znanstveniki prejeli številne zaslužene nagrade za pomemben prispevek k razvoju znanosti. Uporaba nove snovi ni več omejena na znanstvene laboratorije: ogljikova kislina se v industriji uporablja kot močan katalizator.

Edinstvena lastnost najmočnejše kisline na svetu je njena sposobnost interakcije z inertnimi plini. Trenutno potekajo številne študije, ki preučujejo možnost reakcije med ksenonom in ogljikovo kislino. Tudi znanstveniki si neutrudno prizadevajo preučiti druge lastnosti najmočnejše kisline.
Najbolj znana močna kislina
Znanstveniki dobro poznajo ogljikovo kislino. Navadni ljudje pogosto verjamejo, da je najmočnejša žveplova kislina. To je posledica pogoste uporabe snovi v industriji. Proizvajalci mineralnih gnojil ga pogosto uporabljajo za proizvodnjo superfosfatov in amonijevih sulfatov.
Ogljikova kislina
Skupina znanstvenikov s kalifornijske univerze si je skupaj z znanstveniki z inštituta za katalizo sibirske veje Ruske akademije znanosti zadala nalogo sintetizirati močno kislino, ki še ne bi bila agresivna do okoliških materialov. Ta na prvi pogled nemogoča naloga je bila rešena. Ustvarjena spojina je po mnenju znanstvenikov milijonkrat močnejša od žveplove kisline z visoko koncentracijo in hkrati inertna do steklenih posod. Vsaka spojina, katere kislost presega kislost 100% žveplove kisline, se že imenuje superkisline. Kako lahko potem imenujete milijonkrat močnejšo spojino?

Izvedene študije omogočajo trditev, da je ogljikova kislina (in prav to ime je dobila) najmočnejša kislina, ki je bila doslej raziskana.
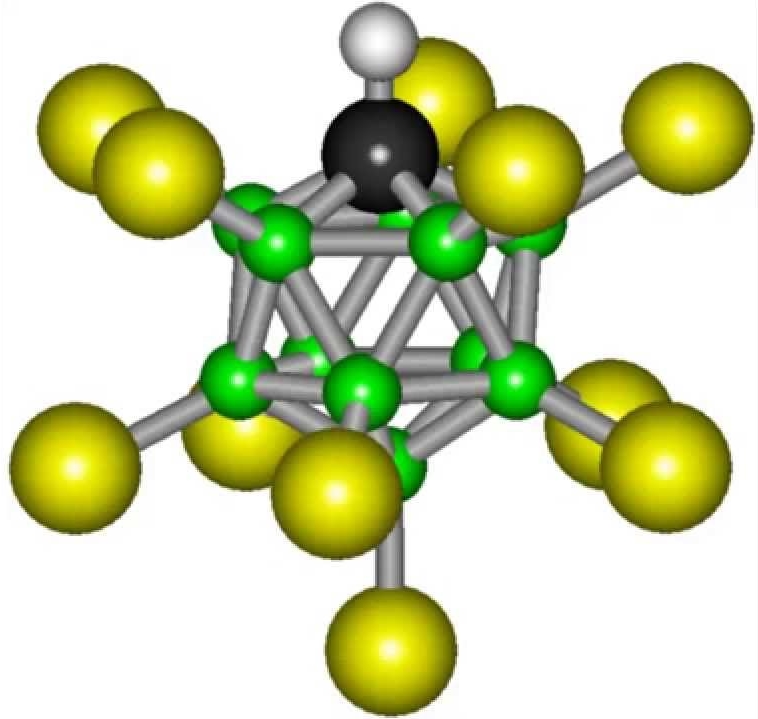
Ta spojina ima kemijsko formulo H (CHB11Cl11) v raztopino oddaja veliko več vodikovih ionov (protonov) kot vse ostale, preostala baza pa ima inertnost, ki navduši vsako domišljijo. Ta skupina vsebuje 11 atomov bora, 11 atomov klora in ogljikov atom - ki so povezani v prostorsko strukturo v obliki ikosaedra. Znano je, da imajo figure s strukturo platonskih trdnih snovi (in to je točno to, kar je ikosaeder) zelo visoko trdnost. In prav ta učinkovita prostorska organizacija baze omogoča kemično inertnost.
Praktična vrednost
Ogljikova kislina je lahko poleg znanstvene vrednosti odkritja in sinteze tudi precejšnje praktične vrednosti. S pomočjo te edinstvene spojine se načrtuje sinteza organskih "kislih" molekul, ki v človeškem telesu nastanejo zelo kratek čas med prebavo hrane in so zato malo raziskane. Ta stabilna bazična struktura daje znanstvenikom pravico, da predlagajo uporabo te kisline v farmacevtski in kemični industriji kot katalizator.

Kemike z vsega sveta preganja ustvarjanje vodikove spojine z inertnimi plini, ki se vedno "neradi" kombinirajo z drugimi elementi periodnega sistema. Trenutno so znane samo ksenonske spojine z najmočnejšim oksidantom, fluorom. Kdo ve, morda jim bo ta drzna ideja uspela s pomočjo ogljikove kisline.
Kemična sinteza ogljikove kisline je nedvomno velik dosežek ruskih in ameriških znanstvenikov. Ta močna kislina je predmet preučevanja in zagotovo bo našla uporabo pri ustvarjanju novih "nenavadnih" snovi.
Mnogi poskušajo sami ugotoviti odgovor na vprašanje, kaj je to - najmočnejša kislina. To ni težko razumeti, vendar je treba prebrati posebno literaturo. Za tiste, ki želijo izvedeti odgovor na to vprašanje, je bil ta članek napisan.
Mnogi ljudje mislijo, da je najmočnejša kislina fluorovodikova kislina, ker lahko raztopi steklo. Ta sodba je praktično neutemeljena. Za razumevanje drugih je najmočnejša kislina žveplova. Zadnja trditev ima povsem logično razlago. Dejstvo je, da je žveplova kislina zelo močna med tistimi, ki se uporabljajo v industriji. Ob stiku z živim tkivom lahko oglene meso in pusti hude opekline, ki se dolgo celijo in so problematične. Njegova proizvodnja ne zahteva posebnih materialnih stroškov. In lahko rečemo, da ni najmočnejša. Znanost pozna tako imenovane super kisline. O njih bomo govorili še naprej. Na ravni gospodinjstva je najpogostejša močna kislina še vedno žveplova. Zato je nevarno.
 Mnogi sodobni kemični znanstveniki menijo, da je najmočnejša kislina na svetu ogljikova kislina. To potrjujejo rezultati temeljitih raziskav. Ta kislina je več kot milijonkrat močnejša od koncentrirane žveplove kisline. Njegova fenomenalna lastnost je sposobnost shranjevanja v epruveti, ki je nimajo številne druge snovi iz omenjene serije. Kemične sestave, ki je veljala za najbolj jedko, ni bilo mogoče shraniti v steklene posode. Dejstvo je, da ima ogljikova kislina znatno kemijsko stabilnost. Tako kot druge podobne snovi pri reakciji z drugimi reagenti podari atome vodika z naboji. Vendar je sestava, ki ostane po reakciji, čeprav ima negativen naboj, zelo stabilna in ne more več delovati. Ogljikova kislina ima preprosto formulo: H (CHB 11 Cl 11). Toda pridobiti že pripravljeno snov v običajnem laboratoriju ni enostavno. Omeniti velja, da je več kot trilijon krat bolj kisla kot navadna voda. Po izumitelju se je ta snov pojavila kot posledica razvoja novih kemikalij.
Mnogi sodobni kemični znanstveniki menijo, da je najmočnejša kislina na svetu ogljikova kislina. To potrjujejo rezultati temeljitih raziskav. Ta kislina je več kot milijonkrat močnejša od koncentrirane žveplove kisline. Njegova fenomenalna lastnost je sposobnost shranjevanja v epruveti, ki je nimajo številne druge snovi iz omenjene serije. Kemične sestave, ki je veljala za najbolj jedko, ni bilo mogoče shraniti v steklene posode. Dejstvo je, da ima ogljikova kislina znatno kemijsko stabilnost. Tako kot druge podobne snovi pri reakciji z drugimi reagenti podari atome vodika z naboji. Vendar je sestava, ki ostane po reakciji, čeprav ima negativen naboj, zelo stabilna in ne more več delovati. Ogljikova kislina ima preprosto formulo: H (CHB 11 Cl 11). Toda pridobiti že pripravljeno snov v običajnem laboratoriju ni enostavno. Omeniti velja, da je več kot trilijon krat bolj kisla kot navadna voda. Po izumitelju se je ta snov pojavila kot posledica razvoja novih kemikalij.
Seznam najbolj jedkih snovi vsebuje fluorovodikove, fluorovodikove in druge močne kisline. Industrijski reagenti niso vključeni. Vendar je še vedno treba biti previden pri tako pogostih kislinah, kot so žveplova, klorovodikova, dušikova in druge. Nikogar ne bi rad prestrašil, toda za izvajanje napadov na zdravje in namerno izkrivljanje videza se običajno uporabljajo snovi s tega seznama.
 Zanimivo dejstvo je, da je med maščobnimi kislinami, ki jih najdemo v hrani, najmočnejša mravljična. Pogosto se uporablja za konzerviranje zelenjave in v medicinske namene, vendar le v obliki raztopine.
Zanimivo dejstvo je, da je med maščobnimi kislinami, ki jih najdemo v hrani, najmočnejša mravljična. Pogosto se uporablja za konzerviranje zelenjave in v medicinske namene, vendar le v obliki raztopine.
Še enkrat je treba reči, da je najmočnejša kislina ogljikova kislina. Danes pa se je treba bolj bati snovi, ki se uporabljajo v industriji in vsakdanjem življenju. Kemija je precej uporabna in zapletena znanost, vendar široka proizvodnja preprostih spojin ne zahteva posebnega znanja, zato je kislino v zadostnih količinah enostavno dobiti. To ustvarja povečano nevarnost v primeru neprevidnega ravnanja ali uresničevanja slabih namenov.
Mnogi poskušajo sami ugotoviti odgovor na vprašanje, kaj je to - najmočnejša kislina. To ni težko razumeti, vendar je treba prebrati posebno literaturo. Za tiste, ki želijo izvedeti odgovor na to vprašanje, je bil ta članek napisan.
Mnogi ljudje mislijo, da je najmočnejša kislina fluorovodikova kislina, ker lahko raztopi steklo. Ta sodba je praktično neutemeljena. Za razumevanje drugih je najmočnejša kislina žveplova. Zadnja trditev ima povsem logično razlago. Dejstvo je, da je žveplova kislina zelo močna med tistimi, ki se uporabljajo v industriji. Ob stiku z živim tkivom lahko oglene meso in pusti hude opekline, ki se dolgo celijo in so problematične. Njegova proizvodnja ne zahteva posebnih materialnih stroškov. In lahko rečemo, da ni najmočnejša. Znanost pozna tako imenovane super kisline. O njih bomo govorili še naprej. Na ravni gospodinjstva je najpogostejša močna kislina še vedno žveplova. Zato je nevarno.
Kako je torej lahko kislina močna in nežna? Odgovor je v tem, kako kemiki določajo jakost kisline. Kislinska jakost je sposobnost kisline, da v svoje osnovne molekule doda vodikov ion. Drug primer je izbira kisline za čiščenje vodnega kamna v bakrenem kotličku, je opozoril. Pameten lastnik hiše izbere klorovodikovo kislino pred dušikovo kislino, ker perklorovodikov del klorovodikove kisline ne napada bakra, medtem ko nitratni del dušikove kisline raztopi kotliček v neredu strupenih rjavih hlapov.
Mnogi sodobni kemični znanstveniki menijo, da je najmočnejša kislina na svetu ogljikova kislina. To potrjujejo rezultati temeljitih raziskav. Ta kislina je več kot milijonkrat močnejša od koncentrirane žveplove kisline. Njegova fenomenalna lastnost je sposobnost shranjevanja v epruveti, ki je nimajo številne druge snovi iz omenjene serije. Kemične sestave, ki je veljala za najbolj jedko, ni bilo mogoče shraniti v steklene posode. Dejstvo je, da ima ogljikova kislina znatno kemijsko stabilnost. Tako kot druge podobne snovi pri reakciji z drugimi reagenti podari atome vodika z naboji. Vendar je sestava, ki ostane po reakciji, čeprav ima negativen naboj, zelo stabilna in ne more več delovati. Ogljikova kislina ima preprosto formulo: H (CHB 11 Cl 11). Toda pridobiti že pripravljeno snov v običajnem laboratoriju ni enostavno. Omeniti velja, da je več kot trilijon krat bolj kisla kot navadna voda. Po izumitelju se je ta snov pojavila kot posledica razvoja novih kemikalij.
Nove "močne, a nežne" kisline imenujemo karbonatne kisline. Skrivnost njihove moči je dvojna. Najpomembneje je, da je karbonatni del kisline izredno šibka baza, šibkejša od fluorosulfatnega dela fluorosulfurne kisline, ki je bil prejšnji rekorder za najmočnejšo kislino. Drugič, karborani imajo izjemno kemijsko stabilnost.
Imajo ikosaedrično razporeditev enajstih atomov bora in enega ogljika, kar je verjetno kemijsko najbolj stabilna skupina atomov v celotni kemiji, je dejal Reed. To pomeni, da ogljikov del kisline ne more sodelovati v kemiji korozije in razgradnje, ki jo kažejo fluorid in nitrat v fluorovodikovi kislini in dušikovi kislini. Posledično lahko ogljikove kisline dodajo vodikove ione šibko bazičnim molekulam, ne da bi uničile pogosto občutljive, pozitivno nabite molekule, ki nastanejo.
Seznam najbolj jedkih snovi vsebuje fluorovodikove, fluorovodikove in druge močne kisline. Industrijski reagenti niso vključeni. Vendar je še vedno treba biti previden pri tako pogostih kislinah, kot so žveplova, klorovodikova, dušikova in druge. Nikogar ne bi rad prestrašil, toda za izvajanje napadov na zdravje in namerno izkrivljanje videza se običajno uporabljajo snovi s tega seznama.
To so njihove močne, a nežne lastnosti, je dodal Reed. Nobena od teh pozitivno nabitih molekul prej ni bila "napolnjena s steklenico" pri sobni temperaturi, ker bi jih prej uporabljene kisline razgradile. Močne, a nežne karbonanske kisline premagajo to težavo, tako da kemikom omogočajo, da si podrobneje ogledajo pomembne molekule, ki običajno obstajajo na minljiv način, je dejal Reed. Zakisane molekule so pomembni kratkotrajni vmesni produkti pri najrazličnejših kislinsko kataliziranih kemičnih transformacijah, vključno s prebavo hrane, izboljšanjem bencina, tvorbo polimerov in farmacevtsko sintezo.
 je, da je med maščobnimi kislinami, ki jih najdemo v hrani, najmočnejša mravljična. Pogosto se uporablja za konzerviranje zelenjave in v medicinske namene, vendar le v obliki raztopine.
je, da je med maščobnimi kislinami, ki jih najdemo v hrani, najmočnejša mravljična. Pogosto se uporablja za konzerviranje zelenjave in v medicinske namene, vendar le v obliki raztopine.
Še enkrat je treba reči, da je najmočnejša kislina ogljikova kislina. Danes pa se je treba bolj bati snovi, ki se uporabljajo v industriji in vsakdanjem življenju. Kemija je precej uporabna in zapletena znanost, vendar široka proizvodnja preprostih spojin ne zahteva posebnega znanja, zato je kislino v zadostnih količinah enostavno dobiti. To ustvarja povečano nevarnost v primeru neprevidnega ravnanja ali uresničevanja slabih namenov.
Kako močne so karboranske kisline? Najmočnejši med njimi je vsaj milijonkrat močnejši od koncentrirane žveplove kisline in stokrat močnejši od prejšnjega rekorderja, fluorovodikove kisline. Koncentrirana žveplova kislina je že več kot milijardo krat močnejša od razredčene kisline v bazenu ali želodčne kisline. Kisla okolja, ki imajo ali presegajo kislost ogljikovih kislin, so bila prej dosežena z dodajanjem antimonovega pentafluorida v fluorovodikovo kislino, vendar so te mešanice zelo jedke in imajo druge omejitve.
Če govorimo v jeziku kemije, so kisline tiste snovi, ki kažejo sposobnost sproščanja vodikovih kationov, ali snovi, ki lahko sprejmejo elektronski par zaradi nastajanja kovalentne vezi. V običajnem pogovoru pa kislino najpogosteje razumemo le kot tiste spojine, ki med nastajanjem vodnih raztopin dajejo presežek H30 +. Prisotnost teh kationov v raztopini daje snovi s kislim okusom in sposobnost reagiranja na kazalnike. V tem članku bomo govorili o tem, katera snov je najmočnejša kislina, pa tudi o drugih kislih snoveh.
Tako močne kisline imenujemo superkisline in reagirajo z ogljikovodiki iz nafte v procesu, imenovanem krekiranje ogljikovodikov. To je pomemben postopek za povečanje oktanske ravni bencina. Nove kisline lahko postanejo zelo pomembne pri razumevanju in izboljšanju tega procesa, je dejal Reed. Ogljikove kisline so to področje popeljale še dlje.
Najbolj znana močna kislina
Obstaja veliko drugih molekul, katerih reakcije s tradicionalnimi kislinami so neurejene in zato niso zelo uporabne. Ogljikove kisline zagotavljajo zelo čisto kislost brez grozljivosti. Tako bi morala biti možna čistejša kislinska kataliza reakcij, pomembnih za proizvodnjo farmacevtskih izdelkov in naftnih derivatov.
Antimonov pentafluorid fluorovodikova kislina (HFSbF5)
Za opis kislosti snovi obstaja indikator PH, ki je negativni decimalni logaritem koncentracije vodikovih ionov. Za običajne snovi je ta kazalnik v razponu od 0 do 14. Vendar ta kazalnik ni primeren za opis HFSbF5, ki se imenuje tudi "super kislina".
Reed pravi: Naša raziskava govori o ustvarjanju molekul, ki jih še nikoli niso storili. Ogljikove kisline nam to omogočajo. To je prava vrednost te raziskave. Znanost se razvija in hkrati študentje doživljajo vznemirjenje odkritja, ko postanejo znanstveniki.
Univerza v Kaliforniji, Riverside, je doktorska raziskovalna univerza, živi laboratorij za pionirske raziskave o vprašanjih, ki so ključna za notranjost južne Kalifornije, državo in skupnosti po vsem svetu. Močna kislina je opredeljena kot vrednost pH, ki je jakost vodika, zaradi česar je kislina močna. Vendar vrednost pH ne deluje v naraščajočem vrstnem redu. Nižja kot je pH vrednost, močnejša bo kislina. Lestvica pH se giblje od 1 do raztopin s pH manj kot 7, veljajo za kisline, raztopine s pH večjim od 7 pa za baze.
Natančnih podatkov o aktivnosti te snovi ni, je pa znano, da je celo 55% raztopina HFSbF5 skoraj 1.000.000 močnejša od koncentrirane H2SO4, ki velja za eno najmočnejših kislin v glavah ljudi. Kljub temu je antimonov pentafluorid dokaj redek reagent, sama snov pa je nastala le v laboratorijskih pogojih. Ne proizvaja se v industrijskem obsegu.
Seznam najmočnejših kislin in njihova uporaba
Kisline s pH manj kot 1 veljajo za najmočnejše, raztopine s pH večjim od 13 pa za močne baze. Vrednost pH je 2 in velja za eno izmed koristnih kislin. Tatarjeva sol ali smetana tatara se naravno razvije med pridelavo vina. Meša se z natrijevim bikarbonatom in se komercialno prodaja kot pecivo. Uporablja se pri pripravi hrane in ima edinstven kiselkast okus.
Dejstvo je, da je on vir diamantov na pokrovu steklenice ali na dnu steklenice. Uporablja se kot organska spojina in jo proizvajajo vsi živi organizmi. Te sladkarije opozarjajo nanje z obveščanjem strank, da lahko dražijo usta. Limono običajno najdemo v limonah in ima pH vrednost. Običajno ga najdemo v citrusih in deluje tudi kot vmesni cikel citronske kisline, ki se pojavi pri presnovi aerobnih organizmov. To je močna in užitna kislina, ki se uporablja v hrani in pijači po okusu, kot so brezalkoholne pijače in brezalkoholne pijače.
Ogljikova kislina (H (CHB11Cl11))
Še ena super kislina. H (CHB11Cl11)) je najmočnejša kislina na svetu, ki jo lahko hranimo v posebnih posodah. Molekula snovi ima obliko ikosaedra. Ogljikova kislina je veliko močnejša od žveplove kisline. Sposoben je raztapljati kovine in celo steklo.
Ta snov je nastala na Kalifornijski univerzi v Združenih državah Amerike ob sodelovanju znanstvenikov iz Novosibirskega inštituta za katalitične procese. Kot je dejal eden od zaposlenih na ameriški univerzi, je bila ideja ustvarjanja želja po ustvarjanju molekul, ki jih prej nihče ni poznal.
Dodajo ga sladoledu, kjer deluje kot emulgator, ki preprečuje sproščanje maščobe. Deluje tudi kot čistilno sredstvo in se lahko uporablja za odstranjevanje apna iz uparjalnikov in kotlov. Zmehča vodo, zato je uporaben pri izdelavi detergentov za perilo in mila. Je brez vonja in se lahko uporablja v kozmetičnih in prehranskih dopolnilih.
Zato se uporablja v številnih industrijskih in domačih izdelkih. Žveplo je znano tudi kot žveplo; pH je 5 in je kemična spojina. Obstaja malo dokazov, da obstaja v raztopini, vendar obstaja v plinski fazi. Osnove za to so običajni anioni, bisulfat in sulfit. Deluje kot redukcijsko sredstvo in razkužilo. Delujejo tudi kot blaga belila in lahko pomagajo tistim materialom, ki jih uničijo klorova belila.
Moč H (CHB11Cl11)) je posledica dejstva, da odlično oddaja vodikov ion. V raztopinah te snovi je koncentracija teh ionov veliko višja kot v drugih. Drugi del molekule po sproščanju vodika vključuje enajst ogljikovih atomov, ki tvorijo ikosaeder, ki je dokaj stabilna struktura, kar povečuje korozijsko inertnost.
PH je 5 in je mineralna kislina. Zaviralec rje Dodatek v hrani Uporablja se v zobozdravstvenih izdelkih Elektrolitno sredstvo Razpršilno sredstvo Industrijsko jedkalo Uporablja se v čistilih za gospodinjstvo. Je tudi kristalinična trdna snov, deluje kot redukcijsko sredstvo in ima konjugirano bazo.
Druga najmočnejša kislina je bolj znani vodikov fluorid. Industrija ga proizvaja v obliki rešitev, najpogosteje štirideset, petdeset ali sedemdeset odstotkov. Snov dolguje svoje ime fluoritu, ki služi kot surovina za vodikov fluorid.
Ta snov je brezbarvna. Ko se raztopi v H20, pride do znatnega segrevanja. Pri nizkih temperaturah lahko HF z vodo tvori šibke spojine.
Absorbira vlago iz zraka in je brezbarvna kristalinična trdna snov. Ob izločanju pri visokih temperaturah tvori sirup in je topen v vodi. Ta vrednost pH je 0 in je brezbarvna tekočina. Uporablja se za. Proizvodnja anorganskih in organskih nitratov Proizvodnja nitro spojin za gnojila Barvila-vmesni produkti Organske kemikalije Eksplozivi. Če je oseba stalno izpostavljena hlapom, lahko povzroči kemični penomonitis in kronični bronhitis.
Snov je jedka za steklo in številne druge materiale. Za transport se uporablja polietilen. Zelo dobro reagira z večino kovin. Ne reagira s parafinom.
Je precej strupen in ima narkotični učinek. Pri zaužitju lahko povzroči akutno zastrupitev, okvaro hematopoeze, okvaro organov, motnje dihal.
Je brezbarvna tekočina, ki pri sproščanju v vodo oddaja bele pare. Druga dva imena za to kislino sta žveplov oksid in žveplov anhidrid. Veliko se uporablja pri proizvodnji kemikalij in eksplozivov. Na primer, uporablja se pri proizvodnji sintetičnih detergentov, zdravil, industrijskih barvil in pigmentov, gnojil itd. dolgotrajna izpostavljenost ima lahko negativne učinke na zdravje in lahko hudo poškoduje človeško telo.
Klorovodikova kislina ima pH vrednost. Je najbolj agresivna in najmočnejša kislina in se uporablja predvsem v laboratoriju. Tvorba te kisline poteka z raztapljanjem vodikovega klorida v vodi. Uporablja se za številne stvari, kot so klorid, gnojila in umiranje. Druge uporabe kisline vključujejo tekstil, galvanizacijo in izdelavo gume. Če je oseba izpostavljena tej močni klorovodikovi kislini, bo izpostavljenost povzročila naslednje.


Snov je močna kislina z dvema bazama. Žveplo v spojini ima najvišje oksidacijsko stanje (plus šest). Brez vonja in barve. Najpogosteje se uporablja v raztopini z vodo ali žveplovim anhidridom.
H2S04 lahko dobite na več načinov:
- Industrijska metoda (oksidacija dioksida).
- Stolpna metoda (proizvodnja z uporabo dušikovega oksida).
- Druge (na podlagi pridobivanja snovi pri medsebojnem delovanju žveplovega dioksida z različnimi snovmi se ne uporabljajo široko).
Koncentriran H2SO4 je zelo močan, vendar njegove rešitve predstavljajo resno nevarnost. Pri segrevanju je dokaj močno oksidant. Pri interakciji s kovinami se oksidirajo. V tem primeru se H2SO4 reducira v žveplov dioksid.
H2SO4 je zelo koroziven. Lahko vpliva na kožo, dihala, sluznico in notranje organe osebe. Zelo nevarno je ne le, da ga vnesemo v telo, ampak tudi vdihavamo njegove hlape.
Mravljična kislina (HCOOH)
Ta snov je nasičena kislina z eno bazo. Zanimivo je, da se kljub svoji moči uporablja kot prehransko dopolnilo. V normalnih pogojih nima barve, se dobro raztopi v acetonu in se zlahka meša z vodo.
HCOOH je pri visokih koncentracijah nevaren. S koncentracijo manj kot deset odstotkov ima le dražilni učinek. Na višjih ravneh lahko razjeda tkiva in številne snovi.
Koncentriran HCOOH v stiku s kožo povzroči zelo hude opekline, ki povzročajo hude bolečine. Hlapi snovi lahko poškodujejo oči, dihalne organe in sluznico. Če pride v notranjost, povzroči resno zastrupitev. Vendar se zelo nizke koncentracije kisline v telesu zlahka predelajo in izločijo.

V primeru zastrupitve z metanolom se v telesu tvori tudi mravljična kislina. Njeno delo v tem procesu vodi do okvare vida zaradi poškodbe vidnega živca.
Ta snov se v majhnih količinah nahaja v plodovih, koprivah, izločkih nekaterih žuželk.
Dušikova kislina (HNO3)
Dušikova kislina je močna enobazna kislina. Dobro se meša s H20 v različnih razmerjih.
Ta snov je eden najbolj priljubljenih izdelkov v kemični industriji. Obstaja več načinov za njegovo pripravo, vendar je najpogosteje uporabljena oksidacija amoniaka v prisotnosti platinskega katalizatorja. HNO3 se najpogosteje uporablja pri proizvodnji gnojil za kmetijstvo. Poleg tega se uporablja na vojaškem področju, pri ustvarjanju eksplozivov, v industriji nakita, za ugotavljanje kakovosti zlata, pa tudi pri ustvarjanju nekaterih zdravil (na primer nitroglicerina).

Snov je zelo nevarna za ljudi. Pare HNO3 poškodujejo dihalne poti in sluznico. Kislina na koži pusti razjede, ki se dolgo časa zacelijo. Poleg tega koža postane rumena.
Ko je izpostavljen toploti ali svetlobi, se HNO3 razgradi v dušikov dioksid, ki je precej strupen plin.
HNO3 ne reagira s steklom, zato se ta material uporablja za shranjevanje snovi. Kislino je prvi pridobil alkimist Jabir.
Več generacij kemikov se je prepiralo o tem, katera kislina je najmočnejša. V različnih časih je ta naslov prejela dušikova, žveplova, klorovodikova kislina. Nekateri so menili, da spojina ne more biti močnejša od fluorovodikove kisline. V zadnjem času so pridobili nove spojine z močnimi kislimi lastnostmi. Morda je med njimi najmočnejša kislina na svetu? Ta članek obravnava značilnosti najmočnejših obstojnih kislin našega časa in daje njihove kratke kemijske lastnosti.
Koncept kisline
Kemija je natančna kvantitativna veda. Naslov "najmočnejša kislina" je treba razumno pripisati eni ali drugi snovi. Kaj je lahko glavni pokazatelj, ki označuje moč katere koli povezave?
Najprej se spomnimo klasične definicije kisline. V bistvu se ta beseda uporablja za kompleksne kemične spojine, ki so sestavljene iz vodika in kislega ostanka. Število vodikovih atomov v spojini je odvisno od valentnosti kislega ostanka. Na primer, v molekuli klorovodikove kisline je samo en atom vodika; in žveplova kislina že ima dva atoma H +.

Lastnosti kislin
Vse kisline imajo nekatere kemijske lastnosti, ki jih lahko imenujemo skupne temu razredu kemičnih spojin.

V vseh zgornjih lastnostih se kaže še ena "spretnost" katere koli znane kisline - to je sposobnost darovanja vodikovega atoma, ki ga nadomesti z atomom druge kemične snovi ali molekulo neke spojine. Prav ta sposobnost označuje "jakost" kisline in stopnjo njene interakcije z drugimi kemičnimi elementi.
Voda in kislina
Prisotnost vode bistveno zmanjša sposobnost kisline za darovanje atomov vodika. To je posledica dejstva, da lahko vodik tvori lastne kemijske vezi med molekulami kisline in vode, zato je njegova sposobnost ločevanja od baze manjša kot pri nerazredčenih kislinah.
Super kislina
Beseda "super kislina" je bila v kemijski slovar uvedena leta 1927 z lahkotno roko slavnega kemika Jamesa Conanta.
Standard za trdnost te kemične spojine je koncentrirana žveplova kislina. Kemikalija ali katera koli zmes, ki presega kislost koncentrirane žveplove kisline, se imenuje super kislina. Vrednost superkisline je določena z njeno sposobnostjo, da na katero koli bazo prenese pozitiven električni naboj. Za osnovni parameter za določanje kislosti se vzame ustrezen indikator H 2 SO 4. Med močnimi kislinami so snovi s precej nenavadnimi imeni in lastnostmi.
Znane močne kisline
Najbolj znane kisline iz anorganske kemije so vodikova kislina (HI), bromovodikova kislina (HBr), klorovodikova kislina (HCl), žveplova kislina (H 2 SO 4) in dušikova kislina (HNO 3). Vsi imajo visok indeks kislosti in so sposobni reagirati z večino kovin in baz. V tej seriji je najmočnejša kislina mešanica dušikove in klorovodikove kisline, imenovana "aqua regia". Formula najmočnejše kisline v tej seriji je HNO 3 + 3 HCl. Ta spojina lahko raztopi celo plemenite kovine, kot sta zlato in platina.

Nenavadno je, da fluorovodikova kislina, ki je spojina vodika z najmočnejšim halogenom - fluorom, ni uspela pretehtati za naslov "Najmočnejša kislina v kemiji". Edina značilnost te snovi je sposobnost raztapljanja stekla. Zato je takšna kislina shranjena v plastični posodi.
Močne organske kisline
Kandidati za naslov "Najmočnejša kislina v organski kemiji" so mravljična in ocetna kislina. Mravljična kislina je najmočnejša v homologni seriji nasičenih kislin. Ime je dobil zaradi dejstva, da ga del vsebuje izločki mravlje.

Ocetna kislina je nekoliko šibkejša od mravljične kisline, vendar je njeno območje porazdelitve veliko širše. Pogosto ga najdemo v rastlinskih sokovih in nastane med oksidacijo različnih organskih snovi.
Nedavni razvoj na področju kemije je omogočil sintezo nove snovi, ki lahko konkurira tradicionalnim organskim snovem. Trifluorometansulfonska kislina ima višjo kislost kot žveplova kislina. Poleg tega je CF3SO3H stabilna higroskopska tekočina z uveljavljenimi fizikalnimi in kemijskimi lastnostmi v normalnih pogojih. Danes se tej spojini lahko dodeli naslov "Najmočnejša organska kislina".
Marsikdo bi si mislil, da stopnja kislosti ne more biti bistveno višja od stopnje žveplove kisline. Toda v zadnjem času so znanstveniki sintetizirali številne snovi, pri katerih so parametri kislosti nekaj tisočkrat višji od vrednosti žveplove kisline. Spojine, pridobljene z interakcijo protonskih kislin z Lewisovimi kislinami, imajo nenormalno visoke vrednosti kislosti. V znanstvenem svetu se imenujejo: kompleksne protonske kisline.
Čarobna kislina
Da. Vse je pravilno. Čarobna kislina. Tako se temu reče. Čarobna kislina je mešanica vodikovega fluorida ali fluor sulforonske kisline s antimonovim pentafloridom. Kemična formula te spojine je prikazana na sliki:

Čarobna kislina je tako čudno ime dobila na božični zabavi kemikov, ki je potekala v začetku šestdesetih let. Eden od članov raziskovalne skupine J. Olaha je izvedel smešen trik z raztapljanjem voščene sveče v tej neverjetni tekočini. To je ena najmočnejših kislin nove generacije, toda snov, ki jo bo po moči in kislosti presegla, je že sintetizirana.
Najmočnejša kislina na svetu
Karboranatna kislina - karboranska kislina, ki je daleč najmočnejša spojina na svetu. Formula za najmočnejšo kislino izgleda tako: H (CHB11Cl11).
Ta pošast je nastala leta 2005 na Kalifornijski univerzi v tesnem sodelovanju z Novosibirskim inštitutom za katalizo SB RAS.
Sama zamisel o sintezi je nastala v glavah znanstvenikov skupaj s sanjami o novih, doslej nevidnih molekulah in atomih. Nova kislina je milijonkrat močnejša od žveplove kisline, medtem ko je popolnoma neagresivna, najmočnejšo kislino pa zlahka shranimo v steklenico. Res je, sčasoma se steklo še vedno raztopi in s povišanjem temperature se hitrost takšne reakcije znatno poveča.

Ta neverjetna mehkoba je posledica visoke stabilnosti nove spojine. Tako kot vse kemikalije, povezane s kislinami, ogljikova kislina zlahka reagira in podari svoj edini proton. V tem primeru je kislinska baza tako stabilna, da se kemična reakcija ne nadaljuje.
Kemijske lastnosti ogljikove kisline
Nova kislina je odličen darovalec protona H +. To je tisto, kar določa jakost te snovi. Raztopina ogljikove kisline vsebuje več vodikovih ionov kot katera koli druga kislina na svetu. V kemični reakciji SbF 5 - antimonov pentafluorid veže fluoridni ilon. S tem se sprošča vedno več atomov vodika. Zato je ogljikova kislina najmočnejša na svetu - suspenzija protonov v njeni raztopini je 2 × 10 19 -krat večja od žveplove kisline.
Vendar je kislinska baza te spojine izjemno stabilna. Molekula te snovi je sestavljena iz enajstih atomov broma in enakega števila atomov klora. V vesolju ti delci tvorijo kompleksno, geometrijsko pravilno figuro, imenovano ikosaeder. Ta razporeditev atomov je najbolj stabilna in to pojasnjuje stabilnost ogljikove kisline.

Vrednost ogljikove kisline
Najmočnejša kislina na svetu je svojim ustvarjalcem prinesla zaslužene nagrade in priznanja v znanstvenem svetu. Čeprav vse lastnosti nove snovi niso v celoti razumljene, je že postalo jasno, da pomen tega odkritja presega laboratorije in raziskovalne inštitute. Ogljikovo kislino lahko uporabimo kot močan katalizator v različnih industrijskih reakcijah. Poleg tega lahko nova kislina medsebojno deluje z najbolj trdovratnimi kemikalijami - inertnimi plini. Trenutno poteka delo, ki dopušča možnost reakcije ksenona.
Nedvomno bodo neverjetne lastnosti novih kislin našle svojo uporabo na različnih področjih znanosti in tehnologije.
Hiter razvoj znanosti omogoča znanstvenikom nova senzacionalna odkritja na področju fizike, kemije in na drugih področjih. Znanstveni svet sistematično pretresa novica o ustvarjanju novih snovi z edinstvenimi, prej nevidnimi lastnostmi. Seveda navadni ljudje ne sledijo vedno takšnim odkritjem. Vsi ne vedo, da je leta 2005 v Ameriki nastala najmočnejša kislina na svetu. Za mnoge najmočnejša kemikalija ostaja žveplova kislina, ki so jo v šoli dobro preučili.
Ogljikova kislina je najmočnejša na svetu
Leta 2005 je znanstvenikom, ki delajo na Kalifornijski univerzi v ZDA, uspelo ustvariti novo kislino brez primere. Izumljena spojina je milijonkrat močnejša od koncentrirane žveplove kisline. Znanstveniki so se v tistem trenutku lotili iskanja nove molekule, ki bi postala pravo odkritje v znanstvenem svetu, in uspeli so doseči pozitiven rezultat.
Formula ogljikove kisline se ne razlikuje po kompleksnosti: H (CHB11Cl11). Kljub temu v običajnem laboratoriju takšne snovi ne bo mogoče sintetizirati. Ogljikova kislina je več kot trilijon krat bolj kisla kot navadna voda.
Edinstvena lastnost najmočnejše kisline
Če kjer koli omenjamo najmočnejšo kislino na svetu, človeška domišljija potegne snov, ki raztopi vse, kar ji pride na pot. Dejansko uničevalne lastnosti sploh niso glavni simptom moči kemikalije. Mnogi so na primer verjeli, da je fluorovodikova kislina najmočnejša kislina, ker raztaplja steklo. Toda to je daleč od resnice. Fluorovodikova kislina razjeda steklene posode, lahko pa jih shranimo v polietilenskih posodah.

Prepoznana kot najmočnejša na svetu, lahko ogljikovo kislino enostavno shranimo v steklene posode. Dejstvo je, da je za to kemikalijo značilna velika kemijska stabilnost. Tako kot druge podobne spojine tudi ogljikova kislina v reakciji z reagenti oddaja nabite atome vodika. Po takšni reakciji ima sestavek rahel negativni naboj in nima uničujočega učinka na okoliške materiale.
Nadaljnje delo z ogljikovo kislino
Seveda so ustvarjalci ogljikove kisline postali znani v svetovni znanstveni skupnosti. Poleg tega so briljantni znanstveniki prejeli številne zaslužene nagrade za pomemben prispevek k razvoju znanosti. Uporaba nove snovi ni več omejena na znanstvene laboratorije: ogljikova kislina se v industriji uporablja kot močan katalizator.

Edinstvena lastnost najmočnejše kisline na svetu je njena sposobnost interakcije z inertnimi plini. Trenutno potekajo številne študije, ki preučujejo možnost reakcije med ksenonom in ogljikovo kislino. Tudi znanstveniki si neutrudno prizadevajo preučiti druge lastnosti najmočnejše kisline.
Najbolj znana močna kislina
Znanstveniki dobro poznajo ogljikovo kislino. Navadni ljudje pogosto verjamejo, da je najmočnejša žveplova kislina. To je posledica pogoste uporabe snovi v industriji. Proizvajalci mineralnih gnojil ga pogosto uporabljajo za proizvodnjo superfosfatov in amonijevih sulfatov.
Žveplova kislina se pogosto uporablja v metalurški industriji. Uporablja se tudi za odstranjevanje oksidacije iz kovin. Proizvodnja tekočih goriv ni popolna brez uporabe žveplove kisline. Z njegovo pomočjo se očistijo naslednji izdelki:
- mazalna olja;
- kerozin;
- parafin;
- mineralne maščobe.

Toda ne samo industrijske uporabe mnoge ljudi prepričajo, da je žveplova kislina najmočnejša na svetu. Podobno mnenje je nastalo zaradi dejstva, da ga snov, ki pride na meso, oglje. Ta lastnost žveplove kisline se pogosto uporablja pri snemanju kriminalnih filmov.
Najmočnejša organska kislina
Če govorimo o najmočnejši kislini v organski kemiji, potem vodstvo tukaj pripada mravljinčni kislini. Snov je bila tako imenovana zaradi odkrivanja v izločanju mravlje. Mravljična kislina ima širok spekter uporabe. Pogosto se uporablja v medicini zaradi svojih analgetičnih in dražilnih lastnosti. Mravljična kislina je prisotna v številnih mazilih, ki se uporabljajo za zdravljenje modric, krčnih žil in edemov. Zdravila s to snovjo se lahko znebijo aken.

Mravljična kislina se pogosto uporablja tudi v kemični industriji. Uporablja se tudi v kmetijstvu in čebelarstvu. Snov se uporablja tudi v hrani kot dodatek E236.
Kljub svoji razširjenosti lahko mravljična kislina predstavlja resno grožnjo. Stik s koncentrirano snovjo na koži povzroči opekline ali hude bolečine. Tudi vdihavanje hlapov mravljične kisline lahko poškoduje dihalne poti. Toda pozitivna lastnost snovi je, da se hitro izloči iz telesa, ne da bi se v njem kopičila.